鋳造は、金属を高温で溶解するため大きなエネルギーを使います。
エネルギーは、すべての物質の大本で、アインシュタインは質量はエネルギーと同等を発見。
太陽の核反応エネルギー利用し、生物が光合成などで貯めた成果が、薪や炭や石炭や石油。
燃やすと熱が出る。熱を動力や電気に変える技術ができて、産業革命以後の現代文明が誕生。現代では、太陽エネルギーを電気に変える技術として、太陽光発電や風力発電が生まれた。
エネルギーとしてもっとも使いやすいのが電気。
電気を貯めるのが電池です。
電池以外では、
・水力発電で余った電力で高いところに水をくみ上げ、不足するときに水を落として発電。
・余った電力で、大きく重い円盤を高速で回転させ、不足するときに回転数を下げて発電。
でも、どこでも、だれでも使えるというわけにはいきません。
歴史的には、ボルタさんが異種金属を塩水を付けた紙で挟んで積み重ね(直列)、最初の電池を作りました。
電池には、3種類。 使い切りの1次電池・充電し繰り返し利用する2次電池・エネルギーを電気に変える3次電池。
電池の原理
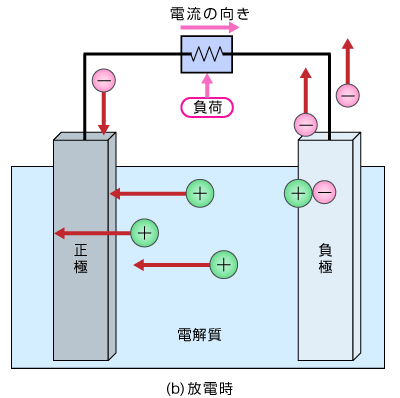
化学反応で電気を貯める・放電するのは、電解質に異種金属が接触するとイオン化傾向の差の電圧が発生し、短絡すると電気が流れることを利用。
放電するとき
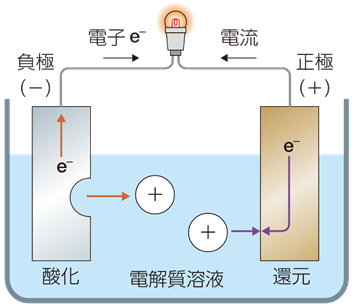
・イオン化傾向が高い方が+イオンで溶け出し(酸化)、残った電子で負極になる。
・電線を通って電子が(イオン化傾向が低く溶けない)正極側へ移動。
・電解質の中を+イオンが正極側に移動し電子と結合して金属に戻る(還元)。
電子が流れ出る極板を「負極(anode)」といい、電子が流れ込む極板を「正極(cathode)」といいます。
電流の定義はプラスの電荷の流れなので、マイナス電子が移動するのとは逆方向。
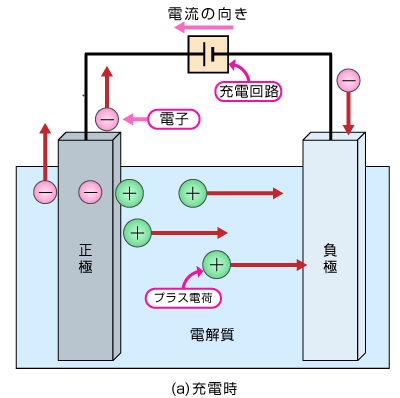
充電するとき
イオン化傾向差より大きな電圧をかけることで、反対の反応が起こります。
解説図がこれ
電気化学での概念解説 高校教師の解説 「生活と化学」 https://sekatsu-kagaku.sub.jp/battery.htm
電池の解説で、解りやすいのを以下に部分引用でご紹介。
松定プレシジョン 技術コラム https://www.matsusada.co.jp/column/kind-of-cell.html
電池の基本 種類と特徴を知る
電池の種類と課題
電池の種類と、それぞれの電池が持っている問題点、課題について紹介しましょう。
まず電池の種類ですが、乾電池などの一次電池と、充電して繰り返し使える二次電池、そして化学反応により発生した電気を継続的に取り出す燃料電池に分けることができます。
一次電池は使い捨てが基本で、内部で発生する化学反応によって電気を取り出しますが、化学反応を行う物質がなくなってしまうとそれ以上は利用することができません。
それに対して繰り返し充放電できるのが二次電池です。同じく内部で発生する化学反応によって電気を取り出しますが、一次電池と異なるのはこの化学反応が可逆反応である点です。放電しきった後、つまり化学反応を行う物質がなくなった後は「充電」を行う事により、反応後の状態から反応前の状態に戻すことができるのです。これによって繰り返し利用することができるようになっています。
ただし、充放電サイクルには上限があり、またメモリ効果による一時的な電圧低下を起こすことがあります。
そして燃料電池は主に水素と酸素を反応させることで電気を発生させます。この場合、水素は水素吸蔵合金に蓄えられたものを充填する方式や、都市ガスの中に含まれるメタン、エタン、プロパン、ブタンといった炭化水素に含まれる水素を遊離させ、空気中の酸素と反応させることで電気を発生させます。したがって水素源となる物質を継続的に提供し続けることができれば、電気を取り出し続けることができます。
各電池の特徴を知ろう
では、それぞれの電池の特徴を紹介していきましょう。
NiCd、NiMH
NiCdはニッケル・カドミウム電池、NiMHはニッケル水素電池を表しています。どちらも正極にニッケル水酸化物を使用している電池で、負極の方にはNiCdはカドミウムを、NiMHは水素吸蔵合金を利用し、電解液はKOH(水酸化カリウム)を主体とした水溶液を使っています。NiCdもNiMHもモーターなどの高出力用途に利用できるという特性がありますが、NiCdはイタイイタイ病を引き起こしたカドミウムを含んでいることから、より安全なNiMHへの置き換えが進んでいます。乾電池型の充電池として手に入るものは、現在ではほとんどがこのNiMHになっています。有名なeneloop、evoltaなどもNiMHです。NiMHの特徴として繰り返しの充放電に強く、安全性も高いというものがあります。一方、メモリ効果が強く、継ぎ足し充電を続けると、取り出せる電気量が減っていくという問題点を抱えています。このメモリ効果をリセットするには、一度、完全に放電しきってから充電を行う必要があります。
LiB
リチウム・イオン蓄電池の略称です。パソコン、スマートフォン、タブレットなど、様々な製品で使われています。乾電池型でない充電式の電池またはバッテリーで、身の回りに存在する電気製品では、ほぼLiBが使われていると考えて良いでしょう。また、電気自動車のバッテリーとしても注目されています。LiBはNiMHの約2.5倍という、非常に高いエネルギー密度を持っているため、携帯電話などのモバイル機器を軽量化するためには必須の蓄電池です。またメモリ効果がないため継ぎ足し充電が可能なことも利点ですし、長期間放置していてもあまり自己放電しません。
| 種類 | 自己放電率(%/月) |
|---|---|
| 鉛 | 3~20% |
| ニカド | 20~45% |
| ニッケル水素 | 15~40% |
| リチウム・イオン | 1~5% |
ただし、エネルギー密度が高い故に、わずかな電圧変動でも過充電になってしまい電池寿命を極端に縮めることにも繋がります。また過充電や過放電を繰り返すと電池の内部圧力が上昇し、破裂や発火事故を引き起こします。スマートフォンが爆発して大やけどをしたというニュースや、航空機でバッテリーが爆発したというニュースを見たことがある人もいるでしょう。
全固体電池
上記の電池の問題点として挙げられるのが「液漏れ」です。長期間入れたままにしていると、電池が膨れてしまって中に入っている電解液が漏出してしまいますが、これが「液漏れ」です。液漏れは短絡の原因になることもありますし、場合によっては内部の回路を破壊してしまいます。液漏れが発生するのは電解質に水溶液を使っているためで、これを回避するために電解質部分を固体にした、全固体電池が開発されています。利点はズバリ、扱いやすく、事故が起こりにくい点でしょう。
一方、欠点もあります。トヨタが電気自動車用に開発している全固体電池は、硫化物系の固体電解質と層状酸化物の正極を採用したリチウム・イオン蓄電池でも、現時点では体積エネルギー密度が200Wh/L程度しかなく、水溶液を電解質に採用しているものの半分未満しかありません。航続距離を伸ばすためには、体積エネルギー密度を400~600Wh/Lまで引き上げる必要があり、現在その開発が進んでいます。
空気電池
空気電池は正極に空気中の酸素を利用し、負極に金属を利用している電池です。補聴器やキッチンタイマーなど、小型で軽量の電気製品に使われています。
主にLi、Na、Caなどのアルカリ金属、アルカリ土類金属を空気中の酸素と化学反応させて電気を取り出しています。従って、使わないときは酸素を遮断するためにシールドしておき、利用時にシールドをはがして装着します。利用する金属(元素)によって電池性能は異なりますが、電解液が必要ないため小型化できるのがメリットです。一方、充電時に金属がデンドライト成長を起こすなど、二次電池化が難しく、どうしてもリサイクルのためのインフラが必要になってしまいます。
燃料電池
燃料電池はこれまで紹介した充電池とは根本的に異なるものです。基本的には発電機と同じであると考えても良いでしょう。つまり何らかの燃料を提供し続けることによって発電機をまわし、電気を生み出しているのです。あまり身の回りにはなさそうな印象がありますが、家庭用の物であればパナソニックの「エネファーム」が家庭用燃料電池の代表例でしょう。基本的には燃料として提供する水素と空気中の酸素とを反応させて水を作る際に出る電気を取り出しています。いわば、理科の実験で行った水の電気分解実験の逆反応によって電気を取り出しているのです。ただし、水素は反応速度が速く、取り扱いに注意が必要であるため、例えば電気自動車への搭載を検討している燃料電池については、水素が周辺に漏れないように、漏れても溜まらないようにするなどの工夫が行われています。
電気二重層キャパシタ
近年注目されているコンデンサの一種です。電池と同じように電極と電解液から構成されていますが、電極間に(電解液が分解しない程度の)電圧をかけた際に、電極と異符号の電荷が電極周辺に増える領域ができます。するとコンデンサのように電位を蓄えることができ、これを電気二重層キャパシタと呼びます。
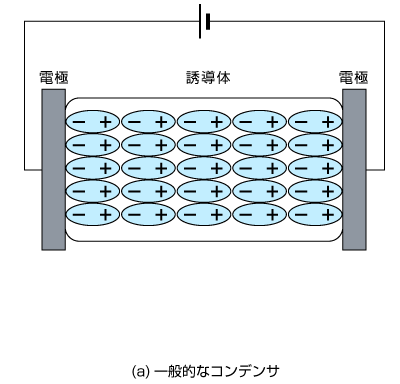
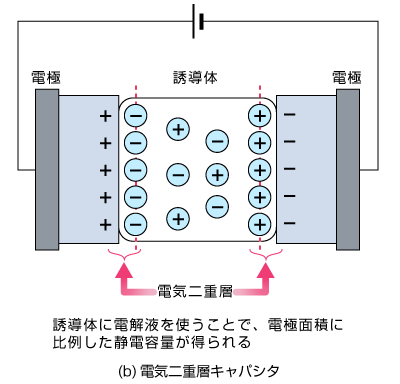
二次電池同様、繰り返し充放電できますが、電気二重層の形成までしか行わないため充放電速度が速いのが特徴です。ただし、二次電池と比較するとエネルギー密度は小さくなります。
一方、セラミックコンデンサと比較すると、エネルギー密度は高くなるものの定格電圧は低いのが現状です。
<引用終わり>
====================================
電気二重層キャパシタは、コンデンサ同様の機器です。
その説明では、日本ケミコンのこのサイトがわかりやすい
https://www.chemi-con.co.jp/products/edlc/knowledge.html
電気二重層キャパシタの特徴
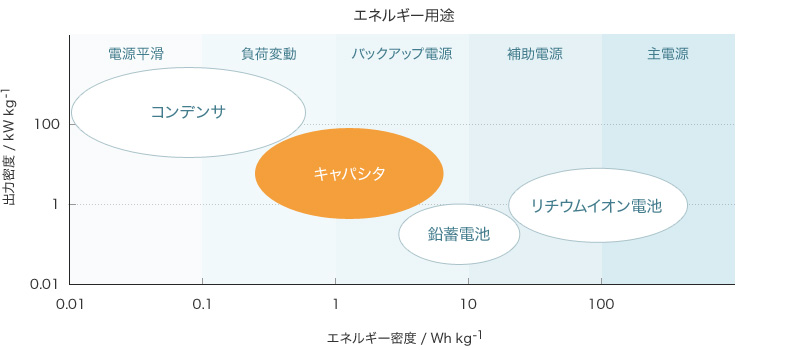
電気二重層キャパシタはコンデンサに分類される蓄電デバイスで、Electric Double Layer Capacitor の頭文字からEDLCとも呼ばれます。よく知られている蓄電デバイスの二次電池とその性能を比較すると、エネルギー密度(単位重量または容積あたりに蓄えられるエネルギーの量)では劣りますが、出力密度(単位重量または容積あたりで瞬間的に取り出すことができる電力の大きさ)で勝るほか、大電流での充放電の繰り返しによる性能劣化が極めて少なく、寿命が長いなどの優れた特徴があります。
代表的な蓄電デバイスの関係をエネルギー密度と出力密度を基準に表すと【表1】のようになります。電気二重層キャパシタは、アルミ電解コンデンサやセラミックコンデンサなどのいわゆる”コンデンサ”と、リチウムイオン電池などの”二次電池”の特性を補完する性質を持っています。より多くのエネルギーを必要とする用途では二次電池、瞬間的な充電・放電や大電流による充電・放電、その繰り返しへの耐久性が求められる用途では電気二重層キャパシタが向いています。
また、電気二重層キャパシタは完全放電が可能です。全エネルギーを放出することができない二次電池に比べると、電気二重層キャパシタは蓄電量に対して取り出せるエネルギーの割合が大きいという特徴を持っています。保持しているエネルギー量の変化に比例して電圧が変動する点は二次電池と同じですが、0Vまで放電できる電気二重層キャパシタは電圧の変動も大きくなるため、負荷によっては電力変換機(DC/DCコンバータ)による電圧安定化が必要になります。一方この性質を利用して、端子電圧を測定することにより、充電したエネルギーの残量を正確に知ることができるというメリットを持っています。
主な特徴
- 数百万サイクルの充放電が可能(長寿命)
- 大電流による急速充放電が可能(高い出力密度)
- 充放電時の損失が少ない(低い内部抵抗)
- 完全放電が可能(放電深度に制限がない)
- 構成材料に重金属を含まない
- 異常時の安全性が高く、外部短絡しても故障しない
以下省略 上記の サイト目次をご覧ください。





